氢氧化钠的溶解度,氢氧化钠溶解度
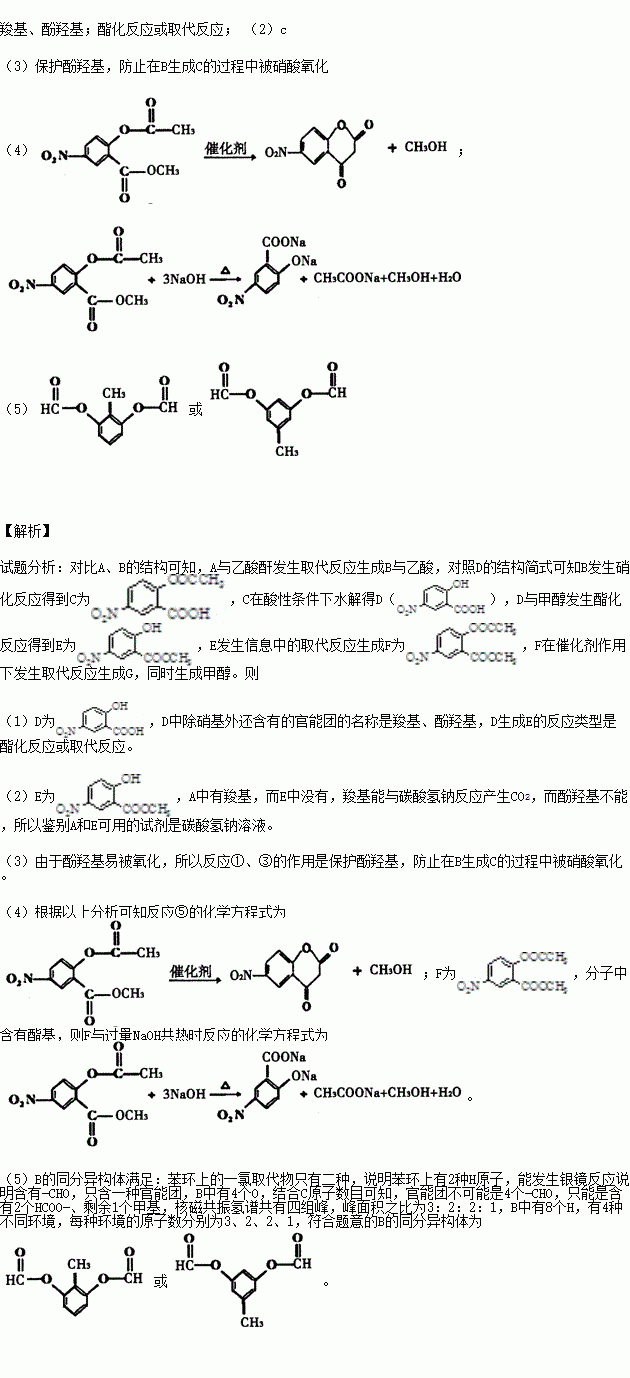
1、氢氧化钠溶解度
氢氧化钠在不同温度下的溶解度具体如下:
1、温度(°C): 0 溶解度(g/100mL):42
2、温度(°C): 10 溶解度(g/100mL):51
3、温度(°C): 20 溶解度(g/100mL):109
4、温度(°C): 30 溶解度(g/100mL):119
5、温度(°C): 40 溶解度(g/100mL):129
6、温度(°C): 50 溶解度(g/100mL):145
7、温度(°C): 60 溶解度(g/100mL):174
8、温度(°C): 70 溶解度(g/100mL):299
9、温度(°C): 80 溶解度(g/100mL):314
10、温度(°C): 90 溶解度(g/100mL):329
11、温度(°C): 90 溶解度(g/100mL):347
:
氢氧化钠的作用
1、化学实验:可以用作化学实验。除了用做试剂以外,由于它有很强的吸水性和潮解性,还可用做碱性干燥剂。
2、化学工业:氢氧化钠在国民经济中有广泛应用,许多工业部门都需要氢氧化钠。使用氢氧化钠最多的部门是化学药品的制造,其次是造纸、炼铝、炼钨、人造丝、人造棉和肥皂制造业。
3、水处理:氢氧化钠被广泛应用于水处理。在污水处理厂,氢氧化钠可以通过中和反应减小水的硬度,在工业领域,是离子交换树脂再生的再生剂。 氢氧化钠具有强碱性,且在水中具有相对高的可溶性。
4、冶金:氢氧化钠被用于处理铝土矿,在铝土矿中含有氧化铝,氧化铝是制取铝的原料。
来源:百度百科-氢氧化钠

2、氢氧化钠 沸点
氢氧化钠的纯品是无色透明的晶体,熔点318.4℃,沸点1390℃,相对密度2.130,易溶于水
。氢氧化钠的溶解度是53g
,即100克的水溶解氢氧化钠53克
3、氢氧化钠的溶解度
氢氧化钠的溶解度是109g/100g。
氢氧化钠介绍如下:
氢氧化钠(Sodium hydroxide),也称苛性钠、烧碱、火碱,是一种无机化合物,化学式NaOH,氢氧化钠具有强碱性,腐蚀性极强,可作酸中和剂、配合掩蔽剂、沉淀剂、沉淀掩蔽剂、显色剂、皂化剂、去皮剂、洗涤剂等,用途非常广泛。
2023年8月26日消息:证监会同意郑州商品交易所烧碱期货及期权注册。下一步,证监会将督促郑州商品交易所做好各项工作,保障烧碱期货及期权的平稳推出和稳健运行。
氢氧化钠的化学性质介绍如下:
氢氧化钠对纤维、皮肤、玻璃、陶瓷等有腐蚀作用,溶解或浓溶液稀释时会放出热量;与无机酸发生中和反应也能产生大量热,生成相应的盐类;与金属铝和锌、非金属硼和硅等反应放Chemicalbook出氢。
与氯、溴、碘等卤素发生歧化反应。能从水溶液中沉淀金属离子成为氢氧化物;能使油脂发生皂化反应,生成相应的有机酸的钠盐和醇,这是去除织物上的油污的原理。
氢氧化钠的检测方法介绍如下:
对库存的氢氧化钠每季度至少检测一次,由于氢氧化钠放置时间过长,表面会与空气中二氧化碳发生反应,因此需要检测其有效成分的含量。将氢氧化钠试样充分溶解后,用标准的盐酸溶液来滴定,且同时用酚酞作指示剂,来测定氢氧化钠有效成分的含量。
取干净的已知重量的称量瓶,加入20g左右的固体氢氧化钠,将盖盖紧称重;再用量筒量取40mL左右的氢氧化钠溶液倒入称量瓶。然后将试样移入500mL锥形瓶中,用蒸馏水冲洗称量瓶3~4次,再加100mL左右蒸馏水,慢慢摇动至全部溶解。
4、氢氧化钠的溶解性强弱?
氢氧化钠易溶于水。
溶解性一般不说强弱 ,根据在20℃时溶解性的大小分为易溶、可溶、微溶和难溶四个等级。
在20℃时溶解度大于10g 属于易溶,溶解度在1g到10g之间属于可溶,溶解度在1g到0.01g之间属于微溶,小于0. 01g属于难溶。

请添加微信号咨询:19071507959
最新更新
推荐阅读
猜你喜欢
关注我们


 留学规划
留学规划  留学考试
留学考试  留学指南
留学指南  留学攻略
留学攻略  留学生活
留学生活  留学信息
留学信息  留学专业
留学专业  留学签证
留学签证  关于我们
关于我们  网站首页
网站首页








